




联系电话
13301380973
一直以来,脂肪组织都被认为是一个能量储存器官,最大的内分泌器官,软组织填充物和吸脂后的废弃物质。
作为最丰富的成人干细胞,脂肪干细胞可分泌多种生长因子和细胞因子,促进组织再生,执行免疫调节;可被诱导分化为多种胚层的组织细胞,在再生医学领域有着广泛的应用潜力,三种脂肪干细胞药物已经上市。但是,脂肪干细胞作为一类新的临床治疗手段,面临着诸多挑战,比如细胞来源的选择,产品质量、生产标准的制定和作用机理的明确,其产业化还需要大量的研究投入。
1、脂肪组织和脂肪干细胞
脂肪组织
脂肪组织存在于所有的哺乳动物和部分非哺乳动物体内,主要分布在皮下组织、腹膜内区域以及多种重要器官表面。
脂肪组织是机体内主要结缔组织之一。虽然“中胚层起源”是目前流行观点,但体内不同部位脂肪出现的时间差异以及分子水平上特点提示,不同部位的脂肪可能起源不同。脂肪组织呈疏松状分布于皮下、内脏周围、肌肉间隙、骨髓及乳房组织,主要功能是将能量以脂类形式长期储存于脂肪细胞中,特别是将体内过多的葡萄糖转化为甘油三酯以便在氧化条件下释放能量,也兼具隔热、缓冲、支持及填充的作用,同时它还是重要的内分泌器官,分泌瘦素(leptin)、雌激素、抵抗素(resistin)及细胞因子(如TNFα)等约500多种因子,统称为“脂肪因子”。
人体脂肪组织主要分为两种:白色脂肪(white adipose tissue, WAT)和褐色脂肪(brown adipose tissue, BAT),WAT包含一个充满整个细胞的脂质液滴,细胞核位于细胞的边缘;BAT包含多个大小不一的脂质液滴,细胞核位于中间位置。除形态差异外,颜色的不同是因为BAT含有大量的线粒体。WAT以甘油三酯和胆固醇酯的形式储存能量,其主要功能是长期储能和绝缘,防止低热量摄入期间机体发生能量不足而疲劳;BAT通过线粒体内膜的解偶联蛋白1(UCP1)使线粒体氧化和磷酸化解偶联,以产生热量来代替化学能的形式消耗能量,在低温和休眠期间控制体内温度平衡。
脂肪组织和分布其间的交感神经一起,协同调节机体的温度稳定。低温、运动、交感神经活动以及微环境的信号分子都会刺激WAT向BAT的转化。根据形态,人体脂肪组织至少还包括另外三种脂肪:骨髓脂肪、乳腺脂肪和机械性脂肪。
脂肪干细胞
脂肪干细胞(adipose derived stem cells,ADSCs)具备分化成各种脂肪细胞的能力,是由血管基质片段(stromal vascular fraction,SVF)中分离提取而来,一般认为在塑料器皿上能够贴壁生长的梭形细胞,常常表达CD31-CD34+等分子标记。
ADSCs是一类从脂肪组织中分离得到的具有多向分化潜能的多能干细胞,属间充质干细胞(MSCs)。
2001年,美国加利福尼亚大学的Patricia Zuk和Min Zhu 首次从人脂肪组织中分离得到脂肪干细胞。蛋白质组学分析,类似于成纤维细胞和MSCs。在所有成人MSCs中,ADSCs是储量最丰富、最易获取的间充质干细胞,从300ml的皮下脂肪组织里可以得到大约2~3×108的ADSCs,是同等体积骨髓来源MSCs的100~1000倍,避免了因长期体外扩增造成基因变异的风险。同时,相对于其他MSCs,ADSCs具有更强的扩增能力。这些特点使ADSCs成为临床应用方面极具吸引力的干细胞来源。通常,ADSCs是指白色脂肪来源的ADSCs。
脂肪组织通过胶原酶消化离心,去除上层悬浮的成熟脂肪细胞和底层少量血细胞后,得到的混合细胞为血管基质组分(stromal vascular fraction,SVF)细胞,其中包含前体脂肪细胞、内皮细胞、周细胞、成纤维细胞、ADSCs、造血干细胞、红细胞、淋巴T/B细胞、巨噬细胞、肥大细胞等,通过SVF培养后得到的贴壁细胞为ADSCs,大约占SVF的3%
来源于不同解剖位置的ADSCs存在明显的“来源依赖性”,包括增殖、分化、免疫表型以及基因表达和对体外培养条件的敏感性等,这是他们不同的起源造成的。体外实验证明,ADSCs可分化为中胚层或外胚层的细胞,还可分泌多种促血管生成因子和抗凋亡因子,具有抗炎症、抗氧化的功能。此外,还可应用于损伤组织的重建,提示ADSCs在再生医学领域有着广泛的应用前景。
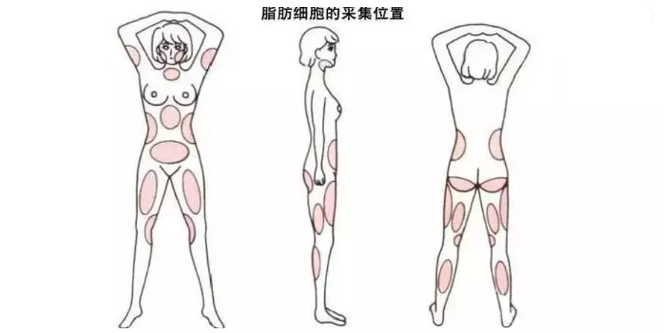
脂肪干细胞,因其来源于脂肪组织,可以通过常规的吸脂术中获取。同时,具有免疫源性低、不涉及伦理问题等优势,获得了越来越多临床研究者的青睐。
2、脂肪干细胞应用于再生医学
针对所有造成机体细胞、组织、器官正常功能发生改变的疾病损伤,进行干预、治疗,促进机体自我修复与再生,或构建新的细胞、组织与器官以维持、修复或改善被损伤的功能,是再生医学的范畴。
这些疾病损伤包括中风、糖尿病、肝病、角膜病变、关节损伤、心脏病、骨关节炎等。动物实验和临床试验结果均显示,ADSCs对于这类难治性疾病损伤大都表现出明显的疗效,在医美领域,ADSCs同样具有显著功效。
相关临床试验
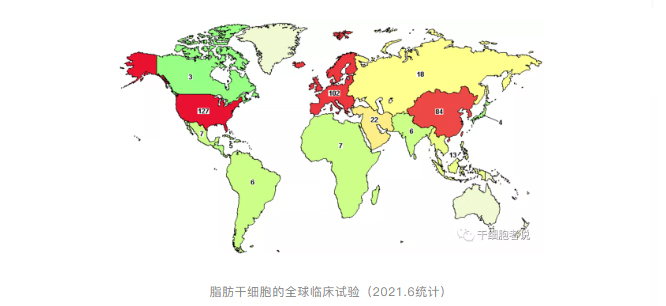
全世界针对脂肪干细胞的临床研究方兴未艾。截至2020年11月30日,共有286个临床研究与ADSCs有关。其中疾病类型包括骨/关节42项、神经32项、瘘31项、医美24项、溃疡18项、心脏16项、血管/血液13项、肺12项、自身免疫11、生殖9项、肾脏7项、糖尿病6项、眼6项、失禁6项、皮肤5项、口腔5项、肝脏4项、肌萎缩4项、泌尿4项、炎症3项、肿瘤3项、脂代谢3项、其他15项。这些临床试验的ADSCs有来自自体也有来自异体,一些实验采用ADSCs和生物材料联合使用。
脂肪干细胞药物
目前,已有三种脂肪干细胞产品在国外被批准应用,分别是2012年在韩国上市的Cuepistem和2018年在欧盟上市的Alofisel,针对克罗恩病合并复杂性肛瘘,前者细胞来自自体,后者来自异体;AstroStem于2018年在日本福冈三一诊所批准商业化使用,适应证是阿尔兹海默症。
据国家药品审评中心的信息,2018年6月至今,国内共有2款脂肪间充质祖细胞新药注册申报获受理开展临床试验,适应症均为膝骨关节炎。
作用机理
虽然体外可以诱导ADSCs分化成多种类型细胞,但在体内ADSCs是否能发生同样的变化,目前难以用实验验证。越来越多的证据表明,ADSCs促进器官、组织的细胞再生的功能是通过分泌多种细胞因子和生长因子来刺激恢复组织原有的正常功能和/或减少组织损伤实现的(表1)。这些因子对于中枢神经系统、免疫系统、心脏、肌肉甚至细胞的基本活性都有正向调节作用。

|
上一条:《自然》重磅:免疫细胞衰老可加速全身衰老,免疫细胞年轻则可延缓衰老
下一条:首例!胎盘间充质干细胞治疗创伤视神经病变,临床结果显著 |
返回列表 |